
Kimyasal Tepkime Türleri ve Özellikleri
Kimyasal tepkimeler, maddelerin etkileşimleri sonucunda yeni bileşenlerin oluşumunu sağlayan süreçlerdir. Bu yazıda, sentez, ayrışma, yer değiştirme, çifte yer değiştirme ve redoks tepkimeleri gibi farklı türleri ve özellikleri üzerinde durulacaktır. Kimya alanındaki bu temel kavramların anlaşılması, endüstriyel ve laboratuvar uygulamaları için kritik öneme sahiptir.
Kimyasal tepkimeler, maddelerin birbirleriyle etkileşimi sonucu yeni maddelerin oluşumunu sağlayan süreçlerdir. Bu tepkimeler, madde dönüşümünü ifade eden temel kimyasal olaylardır ve çeşitli kategorilere ayrılır. Bu makalede, kimyasal tepkime türlerini, özelliklerini ve örneklerini detaylı bir şekilde ele alacağız. 1. Sentez Tepkimeleri Sentez tepkimeleri, iki veya daha fazla elementin veya bileşiğin birleşerek daha karmaşık bir bileşen oluşturduğu tepkimelerdir. Bu tür tepkimelerde, genellikle enerji açığa çıkar veya emilir. Örnekler:
2. Ayrışma Tepkimeleri Ayrışma tepkimeleri, bir bileşiğin daha basit bileşenlerine veya elementlerine ayrıldığı tepkimelerdir. Bu süreç genellikle enerji gerektirir. Örnekler:
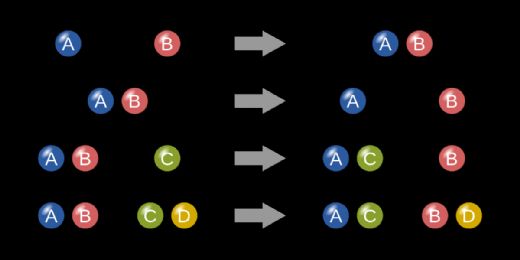
3. Yer Değiştirme Tepkimeleri Yer değiştirme tepkimeleri, bir elementin bir bileşikteki diğer bir elementi yerinden ettiği tepkimelerdir. Bu tepkimeler genellikle tek ve çift yer değiştirme olarak ikiye ayrılır. Örnekler:
4. Çifte Yer Değiştirme Tepkimeleri Çifte yer değiştirme tepkimeleri, iki bileşenin karşılıklı olarak yer değiştirdiği tepkimelerdir. Bu tür tepkimelerde genellikle tuz, su ve gaz oluşabilir. Örnekler:
5. Oksidasyon ve Redüksiyon Tepkimeleri Oksidasyon ve redüksiyon tepkimeleri, elektron transferine dayanan kimyasal tepkimelerdir. Oksidasyon, bir maddenin elektron kaybetmesi, redüksiyon ise bir maddenin elektron kazanmasıdır. Bu tür tepkimeler, enerji üretiminde önemli bir rol oynar. Örnekler:
Ekstra Bilgiler Kimyasal tepkimelerin hızları, çeşitli faktörlerden etkilenir. Bu faktörler arasında sıcaklık, konsantrasyon, yüzey alanı ve katalizörler yer alır. Ayrıca, kimyasal denge, tepkimelerin yönünü belirleyen önemli bir unsurdur ve Le Chatelier ilkesine göre değişkenlere bağlı olarak dengedeki kaymalar yaşanabilir. Kimyasal tepkimelerin anlaşılması, birçok endüstriyel uygulama ve laboratuvar çalışmaları için kritik öneme sahiptir. Sonuç Kimyasal tepkime türleri, maddelerin etkileşimini anlamada temel bir rol oynamaktadır. Sentez, ayrışma, yer değiştirme, çifte yer değiştirme ve redoks tepkimeleri gibi farklı kategoriler, kimya biliminde önemli kavramlardır. Bu tepkimelerin özelliklerinin ve mekanizmalarının anlaşılması, hem teorik hem de pratik uygulamalarda büyük bir öneme sahiptir. |






































Kimyasal tepkimelerin farklı türlerde sınıflandırıldığını öğrendim, ama bir sual aklıma takıldı: Asit ve baz tepkimeleri sonucunda tuz ve su oluştuğunu söylüyorsunuz; peki bu tepkimeler her zaman nötrleşme tepkimesi olarak mı adlandırılıyor yoksa farklı şartlarda farklı isimler mi alıyor?
Merhaba Tağman,
Asit ve baz tepkimeleri sonucunda tuz ve su oluşumu gerçekten de nötrleşme tepkimesi olarak adlandırılır. Ancak, bu tepkimeler bazı şartlara göre farklı adlar da alabilir. Örneğin, eğer bir asit ve bir baz arasında tam bir nötrleşme gerçekleşiyorsa, bu nötrleşme tepkimesi olarak bilinir. Ancak, eğer tepkime sonucunda ortaya çıkan tuzun yapısı ya da tepkimenin çevresi gibi faktörler farklılık gösteriyorsa, bu durumda tepkimenin adı değişebilir. Örneğin, sulu çözeltilerde gerçekleşen nötrleşme tepkimeleri "hidroliz" olarak da bilinebilir. Bu nedenle, tepkimenin genel adı nötrleşme olsa da, şartlara bağlı olarak farklı isimler alabilir.
Umarım sorunuzun cevabını yeterince açıklayabilmişimdir.
Sevgiler,